El calor se define como la transferencia de energía que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa simplemente transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico(ejemplo: una bebida fría dejada en una habitación se entibia).
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, laconducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.
Historia del concepto]
Hasta el siglo XIX se explicaba el efecto del ambiente en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
Calor específico
El calor específico es la energía necesaria para elevar 1 °C la temperatura de un gramo de materia. El concepto de capacidad calorífica es análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
donde:
 es el calor aportado al sistema.
es el calor aportado al sistema. es la masa del sistema.
es la masa del sistema. es el calor específico del sistema.
es el calor específico del sistema.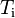 y
y 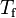 son las temperaturas inicial y final del sistema respectivamente.
son las temperaturas inicial y final del sistema respectivamente. es el diferencial de temperatura.
es el diferencial de temperatura.
Las unidades más habituales de calor específico son J / (kg · K) y cal / (g · °C).
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante. Asimismo, también se diferencia del proceso que se lleve a cabo, distinguiéndose especialmente el "calor específico a presión constante" (en un proceso isobárico) y "calor específico a volumen constante (en un proceso isocórico).
De esta forma, y recordando la definición de caloría, se tiene que el calor específico del agua es aproximadamente:
Calor específico molar]
El calor específico de una sustancia está relacionado su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. A altas temperaturas la mayoría de sólidos tienen capacidades caloríficas molares del orden de  (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 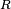 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
 (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 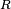 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
donde n indica la cantidad de moles en la sustancia presente. Esta capacidad usualmente es función de la temperatura  .
.
 .
.Capacidad calorífica]
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por 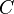 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
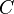 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
Dado que:
De igual forma se puede definir la capacidad calórica molar como:
Cambios de fase.
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce como cambios de fase. Los posibles cambios de fase son:
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación o vaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.
- de estado plasma a gaseoso, llamado Desionización
Calor latente
Un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustanciasdiferentes. Pero lo que es menos evidente es que dos fases o estados de agregación, distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como 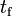 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
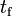 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ello el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido.
El calor de fusión se mide en cal / g.
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por  . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 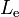 .
.
 . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 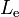 .
.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición, y entalpías de algunas sustancias:
| sustancias | 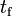 [°C] [°C] |  [cal/g] [cal/g] |  [°C] [°C] | 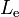 [cal/g] [cal/g] |
| H2O | 0,00 | 79,71 | 100,00 | 539,60 |
| O2 | -219,00 | 3,30 | -182,90 | 50,90 |
| Hg | -39,00 | 2,82 | 357,00 | 65,00 |
| Cu | 1083,00 | 42,00 | 2566,90 |
Transmisión de calor
El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
La conducción pura se presenta sólo en materiales sólidos. La convección siempre está acompañada de la conducción, debido al contacto directo entre partículas de distinta temperatura en un líquido o gas en movimiento. En el caso de la conducción, la temperatura de calentamiento depende del tipo de material, de la sección del cuerpo y del largo del cuerpo. Esto explica por qué algunos cuerpos se calientan más rápido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
- Conductividad térmica
La conductividad térmica de un cuerpo está dada por:
donde:
 es el calor entregado,
es el calor entregado,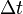 es el intervalo de tiempo durante el cual se entregó calor,
es el intervalo de tiempo durante el cual se entregó calor,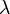 es el coeficiente de conductividad térmica propio del material en cuestión,
es el coeficiente de conductividad térmica propio del material en cuestión, es la sección del cuerpo,
es la sección del cuerpo, es la longitud, y
es la longitud, y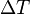 es el incremento en la temperatura.
es el incremento en la temperatura.


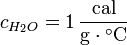

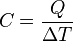
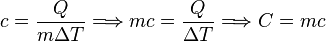



No hay comentarios.:
Publicar un comentario