Proceso isotérmico
Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio a temperatura constante en todo el sistema. La compresión o expansión de un gas ideal puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de Capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco calórico. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
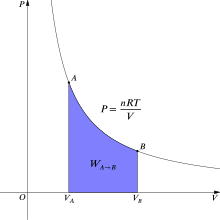
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Proceso isotérmico
Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene:
Entonces integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene:
 ..........(1)
..........(1) Proceso isobárico
Un proceso isobárico es un proceso termodinámico que ocurre a presión constante. La Primera Ley de la Termodinámica, para este caso, queda expresada como sigue: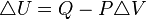 ,
,
Donde: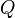 = Calor transferido.
= Calor transferido. = Energía interna.
= Energía interna.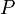 = Presión.
= Presión. = Volumen.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.Proceso isobárico de un gas
Una expansión isobárica es un proceso en el cual un gas se expande (o contrae) mientras que la presión del mismo no varía, es decir si en un estado 1 del proceso la presión es P1 y en el estado 2 del mismo proceso la presión es P2, entonces P1 = P2. La primera ley de la termodinámica nos indica que:Integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene: ..........(1)
..........(1)
Proceso isocórico
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante;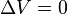 . Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como: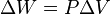 ,
,
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).En un diagrama P-V, un proceso isocórico aparece como una línea vertical.



No hay comentarios.:
Publicar un comentario